¡Hola de nuevo a todos! Hoy es 22 de diciembre, y antes que nada me gustaría concluir el artículo de los modelos atómicos que empecé ayer. Ya hemos visto el de Dalton, el de Thompson y el de Rutherford, así que a continuación expondré los dos que faltan, el de Bohr y el actual, el de Schrödinger.
Modelo Atómico de Bohr
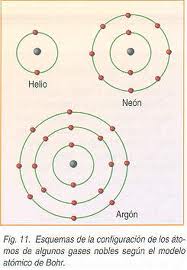
Para explicar las nuevas teorías emergentes que iban apareciendo, especialmente la teoría de cuantización de la materia de Max Planck y el efecto fotoeléctrico de Einstein, Niels Bohr estableció que los electrones giraban en torno al núcleo en órbitas, como si de un sistema solar se tratase. Dichas órbitas comprenden unas características particulares:
-Cada órbita tiene una energía particular, siendo la exterior la más alta.
-Mientras permanezcan en órbitas estables, no irradiaran luz.
-Los electrones pueden saltar de una órbita a otra si ganan o pierden cierta energía. Si ganan 1 Cuanto de energía, saltan a la órbita inmediatamente más alejada del núcleo. Al revés si es 1 Cuanto la que pierden. La energía perdida, se transforma en luz.
Este modelo es muy próximo al actual (el de Schrödinger) pero no es correcto, ya que no explicaba la existencia de las propias órbitas estables y no era válida la determinar la condición de cuantización.
Modelo Atómico de Schrödinger
En 1924, Broglie estableció la naturaleza ondulatoria de la materia, y un físico llamado Erwin Schrödinger la revolucionaría en 1926. Gracias a ello encontró un modelo atómico que despejaba todas las incógnitas. El error de Bohr fue considerar a los electrones esferas diminutas que giran en torno al núcleo, ya que según Schrödinger, estos son y se distribuyen a modo de una función de onda.
El cuadrado de la función de onda representa la "probabilidad de presencia" en una región concreta del espacio (para entendernos, esta zona es la zona órbital). Gráficamente igual lo entendéis mejor, así que he preparado una gráfica con los orbitales para los primeros niveles de energía del hidrógeno por ejemplo.




No hay comentarios:
Publicar un comentario